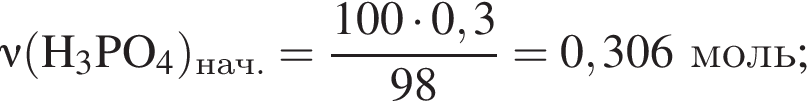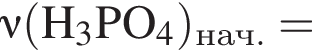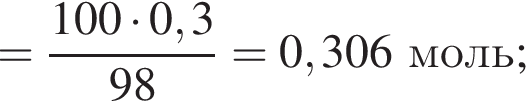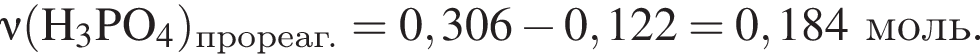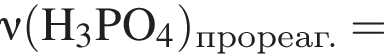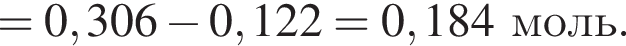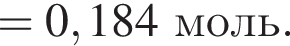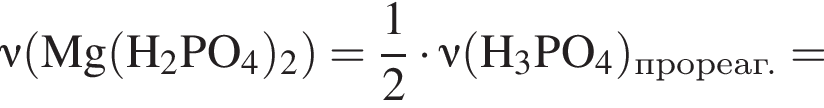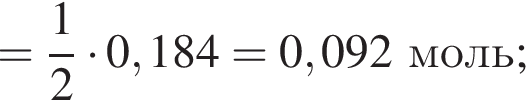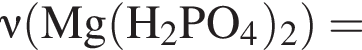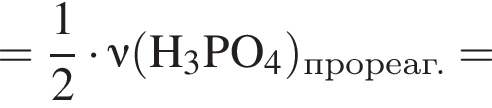Благородным газом является:
Электронная конфигурация атома 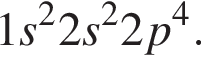 Число энергетических уровней, занятых электронами в атоме, равно:
Число энергетических уровней, занятых электронами в атоме, равно:
Массовое число атома, содержащего 2 нейтрона и 1 электрон, равно:
В ряду химических элементов 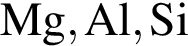 наблюдается:
наблюдается:
Вещество состоит из химических элементов с порядковыми номерами 11 и 17. Укажите тип химической связи между атомами этих элементов в данном веществе:
Фосфор проявляет высшую степень окисления в соединении:
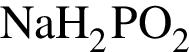 ;
;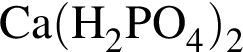 ;
;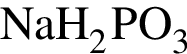 ;
; .
.Образец железной руды массой 100 г состоит из оксида железа(III) и не содержащих железо примесей. Массовая
доля железа в образце равна 67,8 %. Масса (г) оксида железа(III) в данном образце составляет:
Прибор, изображенный на рисунке, используют для выделения вещества из неоднородной смеси методом:
Два кислотных оксида образуются в результате химического превращения:
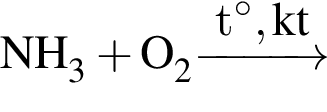 ;
;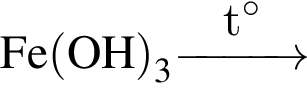 ;
;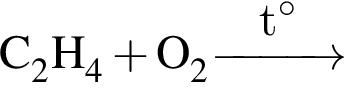 ;
;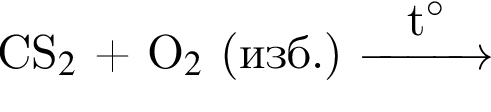 .
.Метиловый оранжевый приобретает жёлтую окраску в водном растворе вещества, которое образуется в результате реакции соединения между:
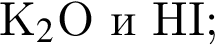
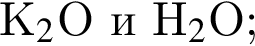
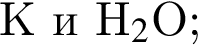
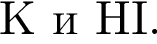
В отличие от разбавленной соляной кислоты разбавленная серная кислота реагирует с:
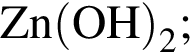
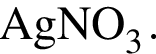
В водный раствор гидроксида натрия небольшими порциями добавляют оксид углерода(IV). при этом сначала образуется:
С водородом могут реагировать все вещества ряда:
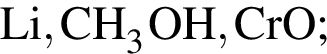
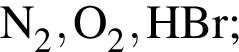
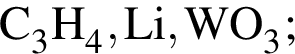
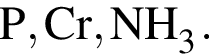
Укажите все верные утверждения. В ряду простых веществ 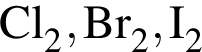 :
:
а) усиливаются восстановительные свойства;
б) при н. у. одно из веществ имеет твёрдое агрегатное состояние;
в) понижается температура плавления;
г) все вещества при взаимодействии с водородом образуют сильные кислоты.
Для получения и собирания кислорода в лаборатории НЕцелесообразно использовать установку:
Медную проволоку нагрели на воздухе до потемнения, а затем охладили и опустили в сосуд, содержащий избыток разбавленной азотной кислоты. Укажите тип реакции, которая НЕ протекала в ходе эксперимента:
Кислотный гидролиз этилацетата приводит к образованию органических веществ А и Б. При взаимодействии А с водным раствором аммиака получается соль В. В результате реакции А с пропанолом-1 в присутствии серной кислоты образуется жидкость Г, имеющая характерный запах. Нагревание Б с серной кислотой до температуры 180 °C приводит к выделению газа Д. Установите соответствие между веществом, обозначенным буквой, и молярной массой (г/моль) вещества.
А
Б
В
Г
Д
1) 28
2) 46
3) 60
4) 77
5) 102
Ответ запишите в виде сочетания букв и цифр, соблюдая алфавитную последовательность букв левого столбца, например: А4Б1В1Г2.
Выберите три утверждения, верно характеризующие глицин.
| 1 | является гомологом аланина |
| 2 | реагирует с бромоводородной кислотой |
| 3 | НЕ реагирует с гидроксидом бария |
| 4 | в лаборатории получают из анилина |
| 5 | является продуктом кислотного гидролиза белков |
| 6 | кристаллическое вещество (н. у.), хорошо растворимое в воде |
Ответ запишите цифрами (порядок записи цифр не имеет значения), например: 123.
При пропускании паров этанола массой 460 г в присутствии кислорода над медным катализатором в реакцию каталитического окисления вступило 45 % спирта, остальной спирт не прореагировал. Рассчитайте массу (г) кислорода, необходимого для полного сжигания полученной смеси органических веществ.
Порцию природной аминокислоты массой 330 г разделили на две равные части. Одну часть обработали избытком хлороводорода, в результате чего образовалась соль массой 245,3 г. Вторую часть обработали избытком водного раствора гидроксида натрия. Найдите массу (г) образовавшейся при этом соли. Ответ округлите до целых.
Определите сумму молярных масс (г/моль) органических веществ молекулярного строения Б, Д и ионного строения Г, полученных в результате следующих превращений:
Для получения веществ по схеме превращений
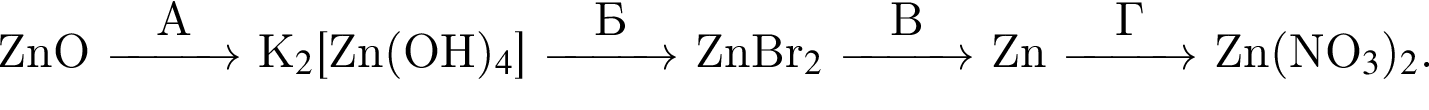
Для осуществления превращений выберите четыре реагента из предложенных (электролиты взяты в виде разбавленных водных растворов):
1) ![]()
2) 
3) ![]()
4) ![]()
5) 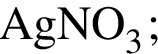
6) ![]()
7) ![]()
Ответ запишите в виде сочетания букв и цифр, соблюдая алфавитную последовательность букв, например: А4Б1В5Г2.
Установите соответствие между парой веществ и реагентом, позволяющим различить вещества пары. Все реакции
протекают в разбавленном водном растворе.
А) 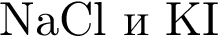
Б) 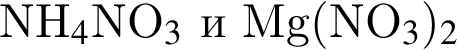
В) 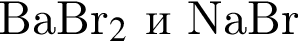
Г) 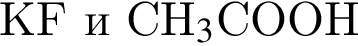
1) 
2) 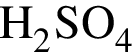
3) 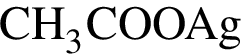
4) ![]()
Ответ запишите в виде сочетания букв и цифр, соблюдая алфавитную последовательность букв левого столбца,
например: А1Б4ВЗГ2.
Выберите четыре утверждения, верно характеризующие графит.
| 1 | встречается в природе |
| 2 | сгорает в избытке кислорода с образованием углекислого газа |
| 3 | имеет такой же качественный состав, как и кварц |
| 4 | обладает электропроводностью |
| 5 | при взаимодействии с натрием образует карбонат металла |
| 6 | в реакциях проявляет восстановительные и окислительные свойства |
Ответ запишите цифрами (порядок записи цифр не имеет значения), например: 3456.
Для восполнения дефицита магния в организме назначают пищевую добавку в виде соли, которая содержит 20 % магния, 26,7 % серы и 53,3 % кислорода по массе. Суточная потребность взрослого человека в магнии составляет 0,34 г. вычислите массу (г) данной соли, которая необходима для обеспечения организма магнием на неделю при условии его усвоения на 36 %.
К порции раствора нитрата натрия массой 300 г при температуре 40 °C добавили эту же соль массой 100 г и тщательно перемешали. После фильтрования полученной смеси оказалось, что 40 г соли не растворилось. Рассчитайте массовую долю (%) нитрата натрия в исходном растворе, если при температуре 40 °C растворимость этой соли равна 100 г в 100 г воды.
В герметичный сосуд постоянного объема поместили медный порошок массой 220 г и заполнили сосуд воздухом объёмом (н. у.) 140 дм3. В результате прокаливания порошка плотность газа в сосуде снизилась на 16 %. Опреде лите массу (г) твердого остатка после прокаливания.
Термохимическое уравнение синтеза аммиака 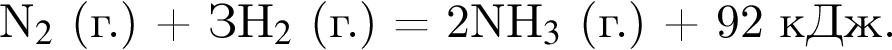 Смесь азота с водородом общим объёмом (н. у.) 200 дм3 поместили в реактор постоянного объёма для синтеза аммиака. За счет протекания реакции общее количество газов в реакторе уменьшилось в 1,12 раза. Вычислите, какое количество теплоты (кДж) выделилось при этом.
Смесь азота с водородом общим объёмом (н. у.) 200 дм3 поместили в реактор постоянного объёма для синтеза аммиака. За счет протекания реакции общее количество газов в реакторе уменьшилось в 1,12 раза. Вычислите, какое количество теплоты (кДж) выделилось при этом.
Дана обратимая реакция

Установите соответствие между между воздействием на равновесную систему и смещением равновесия в результате этого воздействия.
А) увеличение концентрации хлора
Б) уменьшение концентрации ![]()
В) повышение температуры
1) влево
2) вправо
3) НЕ смещается
Ответ запишите в виде сочетания букв и цифр, соблюдая алфавитную последовательность букв левого столбца, например: А1Б3ВЗ. Помните, что некоторые данные правого столбца могут использоваться несколько раз или вообще не использоваться.
Установите соответствие между формулами реагентов и суммой коэффициентов в сокращенном ионном уравнении реакции между ними в разбавленном водном растворе.
А) ![]() и
и 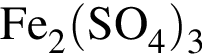
Б) ![]() и
и ![]()
В) 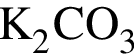 и
и 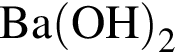
Г) ![]() и
и ![]()
1) 6
2) 7
3) 3
4) 4
5) 5
Ответ запишите в виде сочетания букв и цифр, соблюдая алфавитную последовательность букв левого столбца, например: А1Б4ВЗГ1. Помните, что некоторые данные правого столбца могут использоваться несколько раз или вообще не использоваться.
Найдите сумму молярных масс (г/моль) алюминийсодержащих веществ В и Г, полученных в результате превращений:
Смесь, состоящая из равных химических количеств аммиака и кислорода, имеет массу 215,6 г. Найдите объем (дм3, н. у.) данной смеси.
Клубеньковые бактерии, живущие в земле в симбиозе с бобовыми растениями, накапливают в год 400 кг элемента азота на 1 га почвы. Вычислите массу (кг) сульфата аммония, способного заменить азот, для накопления которого на 0,14 га почвы понадобилось бы 1,5 года.
Дано термохимическое уравнение сгорания этена:
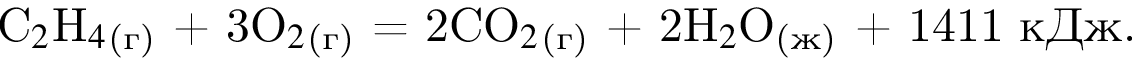
Рассчитайте, какое количество теплоты (кДж) выделится, если в реакцию вступит 86,8 г смеси этена и кислорода, взятых в объемном соотношении 1:3 соответственно.
В избытке воды растворили 25 г медного купороса, а затем — 14 г сульфида бария. Образовавшуюся смесь профильтровали, осадок отделили и высушили. Вычислите массу (г) полученного в результате эксперимента твердого остатка.
Рассчитайте, какую массу (г) железного купороса  необходимо добавить в раствор массой 275 г с массовой долей сульфата железа(II) 5%, чтобы приготовить раствор с массовой долей соли 12%.
необходимо добавить в раствор массой 275 г с массовой долей сульфата железа(II) 5%, чтобы приготовить раствор с массовой долей соли 12%.
Порцию порошка карбоната магния нагрели до высокой температуры. При этом масса порошка снизилась на 40%. Определите, с каким выходом (%) протекала реакция разложения.
К раствору фосфорной кислоты массой 100 г с массовой долей кислоты 30% добавили кусочек магния. В результате реакции образовался прозрачный раствор, содержащий кислоту массой 12 г и соль с массовой долей фосфора 28,44%. Найдите массу (г) соли в полученном растворе.

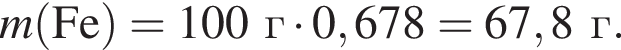
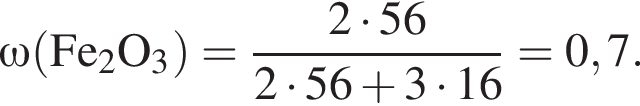


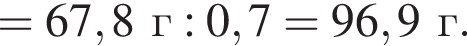
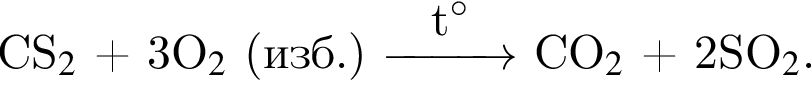
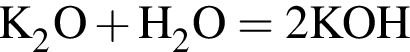
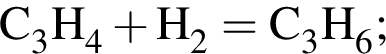
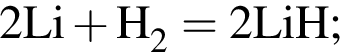
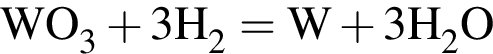
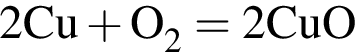 — гетерогенная, соединения, ОВР;
— гетерогенная, соединения, ОВР;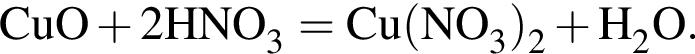 — гетерогенная, обмена, не ОВР.
— гетерогенная, обмена, не ОВР.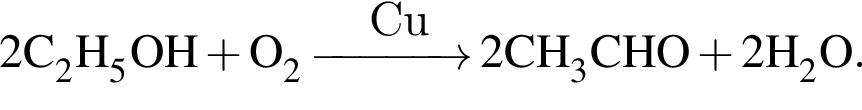
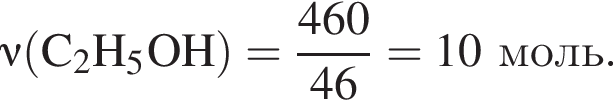
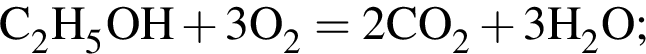
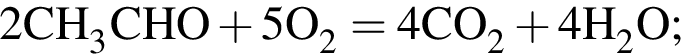
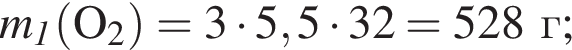
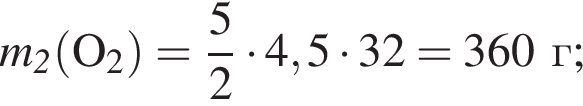
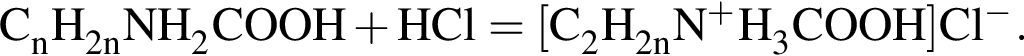


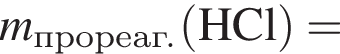
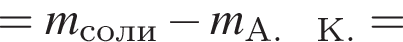
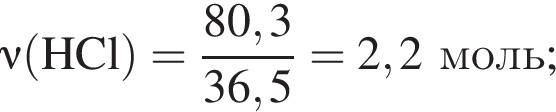

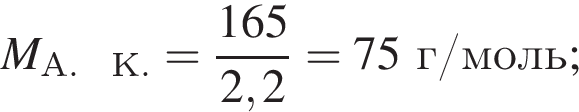
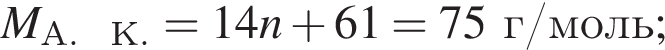
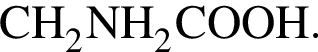
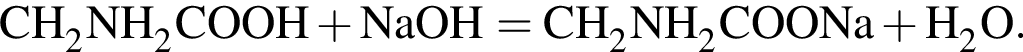
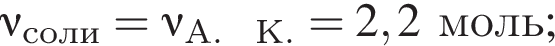
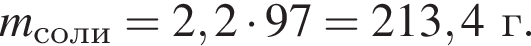
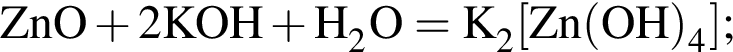
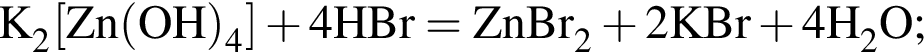
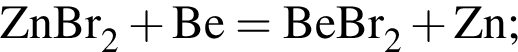
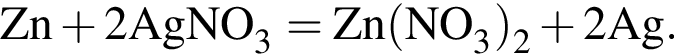
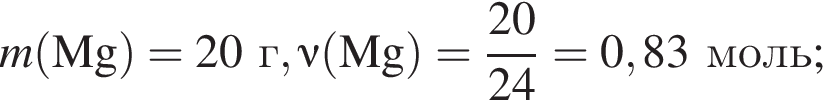
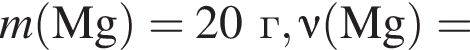
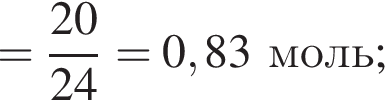
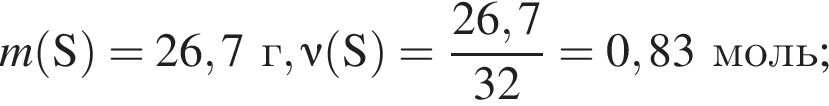
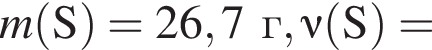
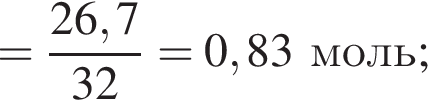
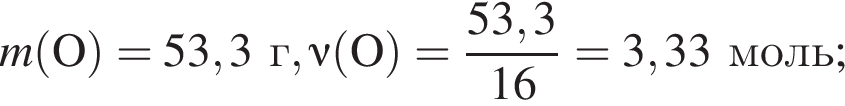
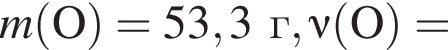
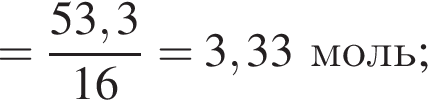
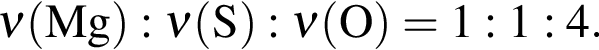
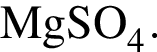
 Тогда 11,9 г — это 36 % от того, что должен получать человек. Отсюда истинная масса сульфата магния на неделю составит
Тогда 11,9 г — это 36 % от того, что должен получать человек. Отсюда истинная масса сульфата магния на неделю составит 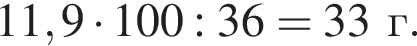
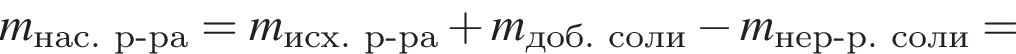
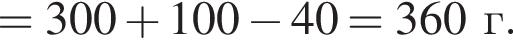
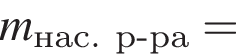
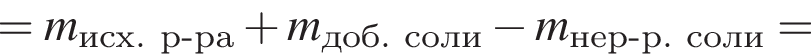
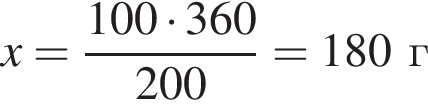 соли в получившемся насыщенном растворе.
соли в получившемся насыщенном растворе.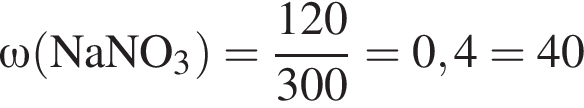 %.
%.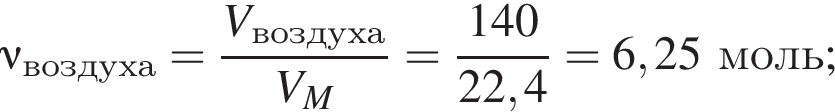
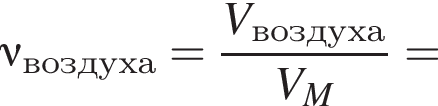
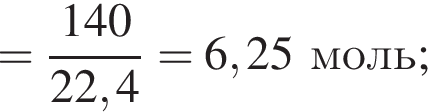




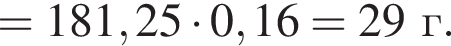

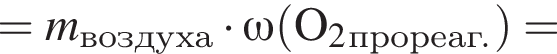
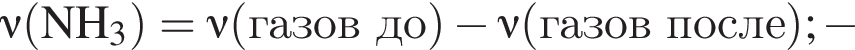
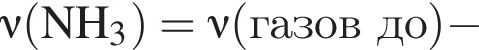
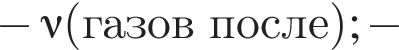
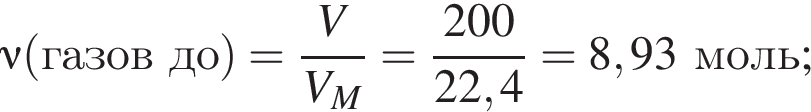
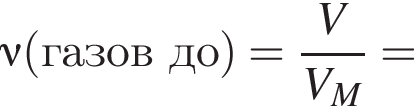
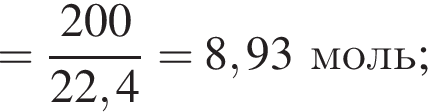
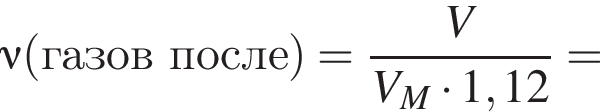
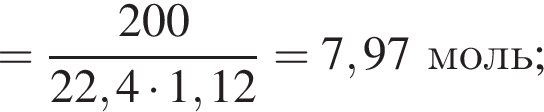
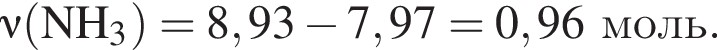
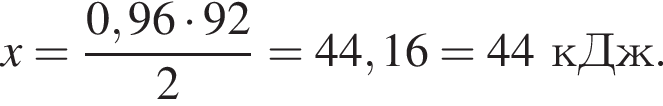
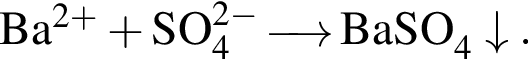 Сумма коэффициентов — 3;
Сумма коэффициентов — 3;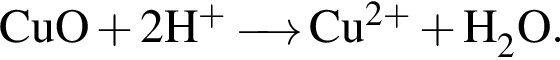 Сумма коэффициентов — 5;
Сумма коэффициентов — 5;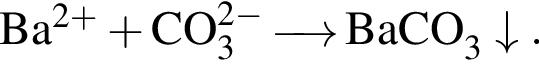 Сумма коэффициентов — 3;
Сумма коэффициентов — 3;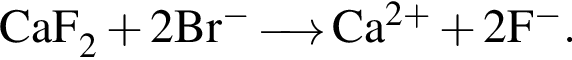 Сумма коэффициентов — 6.
Сумма коэффициентов — 6.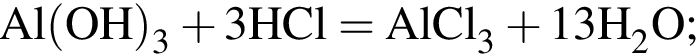
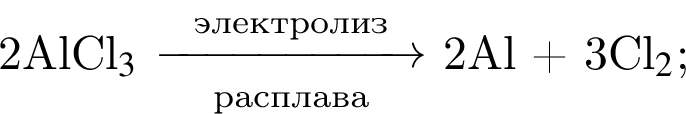
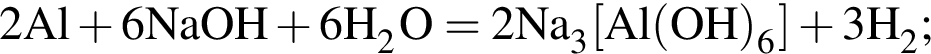
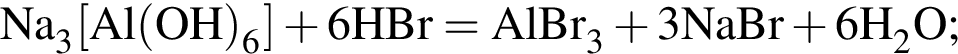



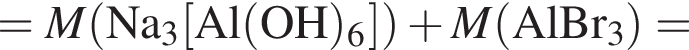
 Следовательно, количество вещества кислорода тоже равно
Следовательно, количество вещества кислорода тоже равно 
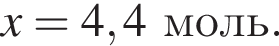
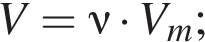
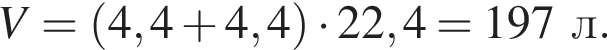
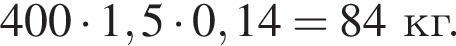 Теперь найдем, какое массовую долю занимает элемент азот в сульфате аммония:
Теперь найдем, какое массовую долю занимает элемент азот в сульфате аммония: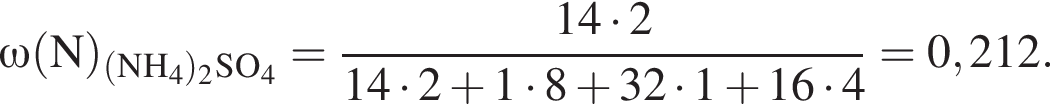

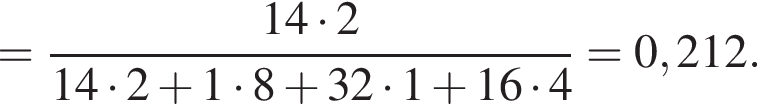
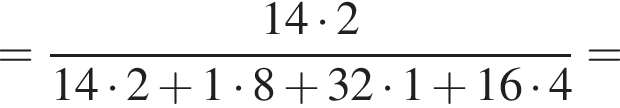
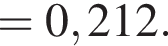
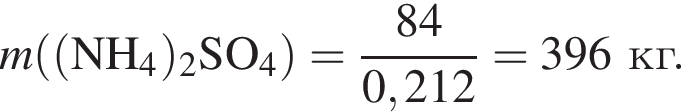
 Тогда:
Тогда: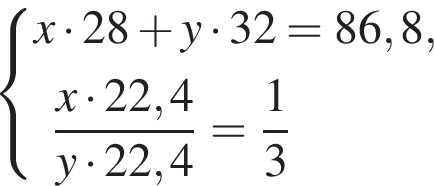
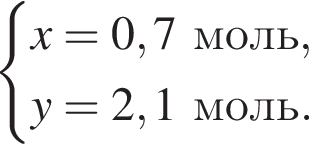
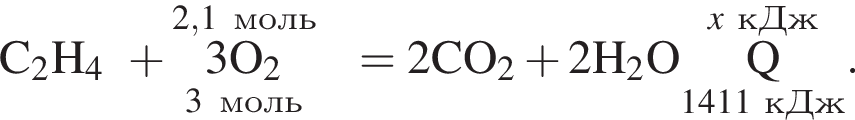
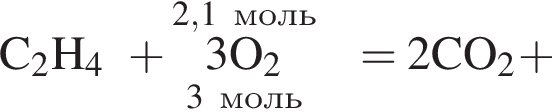
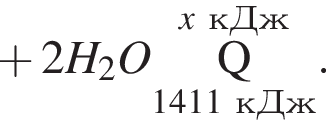
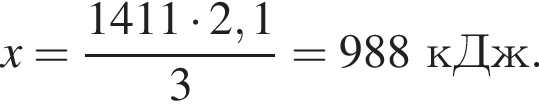


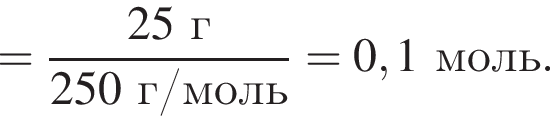

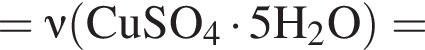

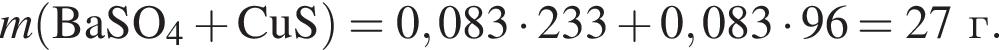
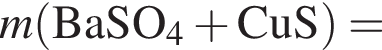
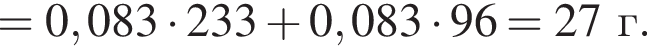
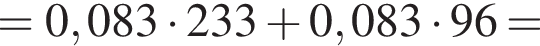




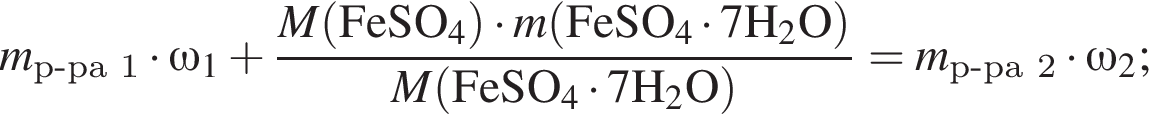
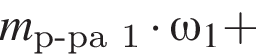
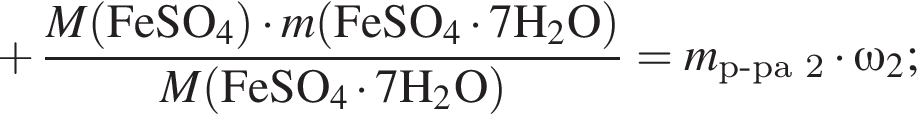
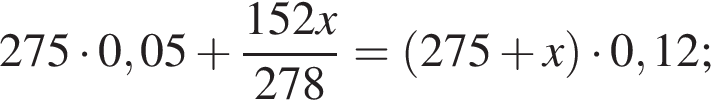
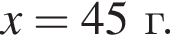
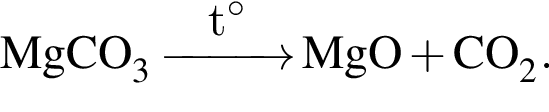

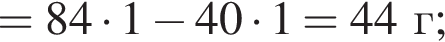
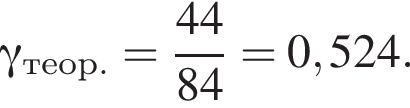
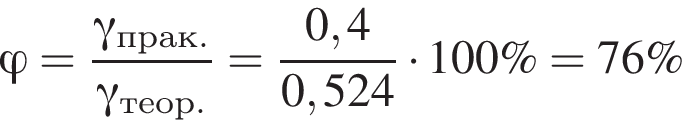
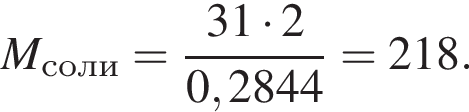
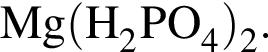 Запишем уравнение реакции:
Запишем уравнение реакции: